來源: 編輯:匿名 發表時間:2024-11-03 16:56:45 熱度:7
國家藥監局最新通告,發現19批次藥品不符合規定。具體名單如下↓↓
10月31日
國家藥監局發布通告稱
經江蘇省食品藥品監督檢驗研究院等
11家藥品檢驗機構檢驗
共17家企業生產的19批次藥品不符合規定
詳情如下:
國家藥監局關於19批次藥品不符合規定的通告
(2024年第47號)
經江蘇省食品藥品監督檢驗研究院等11家藥品檢驗機構檢驗,共17家企業生產的19批次藥品不符合規定。現將相關情況通告如下:
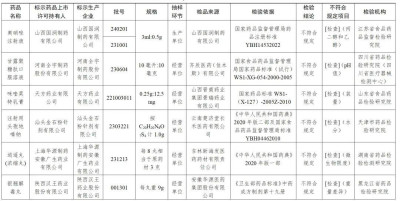
一、經江蘇省食品藥品監督檢驗研究院檢驗,標示爲山西國潤制藥有限公司生產的2批次奧硝唑注射液不符合規定,不符合規定項目爲丙二醇和乙醇。
經四川省藥品檢驗研究院(四川省醫療器械檢測中心)檢驗,標示爲河南全宇制藥股份有限公司生產的1批次甘露聚糖肽口服溶液不符合規定,不符合規定項目爲pH值。
經山東省食品藥品檢驗研究院檢驗,標示爲天方藥業有限公司生產的1批次咪喹莫特乳膏不符合規定,不符合規定項目爲裝量。
經天津市藥品檢驗研究院檢驗,標示爲汕頭金石粉針劑有限公司生產的1批次注射用頭孢地嗪鈉不符合規定,不符合規定項目爲水分。
經湖南省藥品檢驗檢測研究院檢驗,標示爲上海華源制藥安徽廣生藥業有限公司生產的1批次逍遙丸(濃縮丸)不符合規定,不符合規定項目爲微生物限度。
經黑龍江省藥品檢驗研究院檢驗,標示爲陝西漢王藥業股份有限公司生產的2批次銀翹解毒丸不符合規定,不符合規定項目爲重量差異。
經寧波市藥品檢驗所檢驗,標示爲天地恆一制藥股份有限公司生產的1批次一清顆粒不符合規定,不符合規定項目爲粒度。
經吉林省藥品檢驗研究院檢驗,標示爲西安萬隆制藥股份有限公司生產的1批次棗仁安神顆粒不符合規定,不符合規定項目爲性狀。
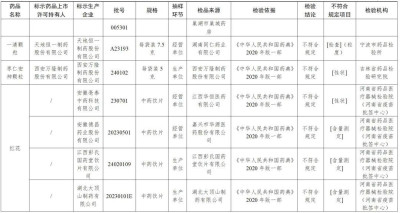
經河南省藥品醫療器械檢驗院(河南省疫苗批籤中心)檢驗,標示爲安徽亳泰中藥科技有限公司、上海匯濟藥業蕪湖有限公司生產的2批次紅花不符合規定,不符合規定項目爲性狀;標示爲安徽德昌藥業股份有限公司、江西彭氏國藥堂飲片有限公司、湖北大頂山制藥有限公司、四川新荷花中藥飲片股份有限公司生產的4批次紅花不符合規定,不符合規定項目爲含量測定。
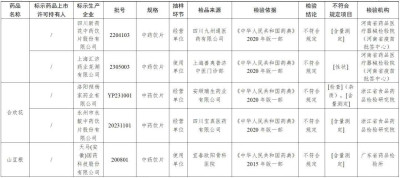
經浙江省食品藥品檢驗研究院檢驗,標示爲洛陽禎楊家藥業有限公司生產的1批次合歡花不符合規定,不符合規定項目爲雜質、含量測定;標示爲永州市永靛中藥飲片股份有限公司生產的1批次合歡花不符合規定,不符合規定項目爲含量測定。
經廣東省藥品檢驗所檢驗,標示爲天馬(安徽)國藥科技股份有限公司生產的1批次山豆根不符合規定,不符合規定項目爲含量測定。
二、對上述不符合規定藥品,藥品監督管理部門已要求相關企業和單位採取暫停銷售使用、召回等風險控制措施,對不符合規定原因开展調查並切實進行整改。
三、國家藥品監督管理局要求相關省級藥品監督管理部門依據《中華人民共和國藥品管理法》,組織對上述企業和單位存在的涉嫌違法行爲立案調查,並按規定公开查處結果。
特此通告。
附件:
1.19批次不符合規定藥品名單
2.不符合規定項目的小知識
國家藥監局
2024年10月29日
19批次不符合規定藥品名單
(點擊大圖查看)
▌本文來源:國家藥監局官網
編輯:葉明璐
一審:武銀鳳
二審:張華夏
三審:董 華
投稿郵箱:yongqiaonews@163.com
所投稿件需爲原創稿件。要求圖片清晰、文章邏輯清晰。
所投稿件需詳細標注作品名、作者名以及作者詳細聯系方式。
埇橋區融媒體中心新媒體矩陣
| “宿州埇橋發布”微信 | “看埇橋”APP |
| “宿州埇橋發布”微博 | “宿州埇橋發布”視頻號 |
NEWS
標題:官方通報!暫停銷售、召回!
地址:https://www.vogueseek.com/post/97539.html
鄭重聲明:本文版權歸原作者所有,轉載文章僅為傳播信息之目的,不構成任何投資建議,如有侵權行為,請第一時間聯絡我們修改或刪除,多謝。
上一篇 : 賞金秋紅葉,遊紅色景點,紅色大悟的綠色產業路
